近日,生命科学与健康工程学院吴静教授团队在挖掘天然老黄酶的新功能催化MBH反应研究方面取得进展。研究成果以“Unlocking the function promiscuity of old yellow enzyme to catalyze asymmetric Morita-Baylis-Hillman reaction”为题于2024年7月发表在Nature Communications杂志上。江南大学博士研究生王蕾为第一作者,生命科学与健康工程学院宋伟副研究员为通讯作者。
Morita-Baylis-Hillman (MBH)反应是一种重要的C-C键形成反应,是指在合适的亲核催化剂催化下,活化烯烃(例如:α,β-不饱和羰基化合物)与碳亲电试剂(例如:醛)之间形成C-C键的原子经济反应,其产物具有广泛的生物活性,包括抗癌、降糖、抗炎、抗病毒、抗菌等。开发高效的酶催化MBH反应方法,将极大促进手性药物合成,推动制药工业的发展。该研究旨在探索利用老黄酶(old yellow enzymes, OYEs)的底物相似性,开发其催化反应的功能多样性。
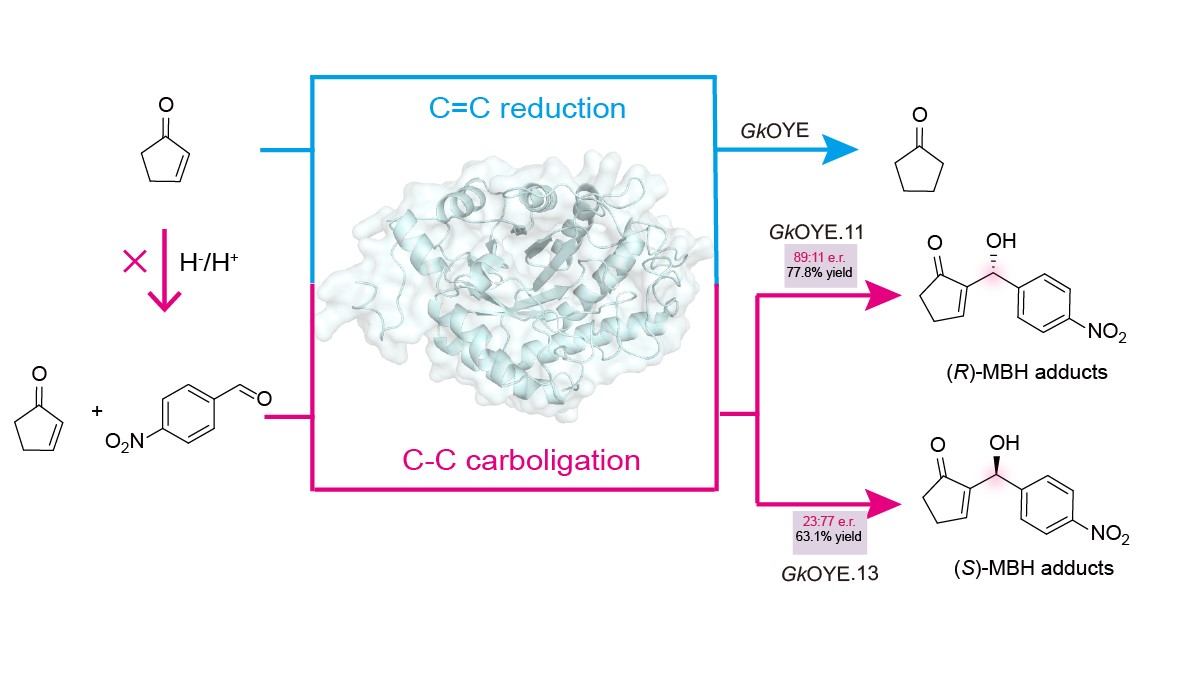
(1)该研究首先基于MBH反应和OYEs还原反应的底物相似性,提出OYEs可能具有催化MBH反应的功能。通过质谱和光谱实验,证实了GkOYE等多种OYEs确实能催化MBH反应生成目标产物。随后,通过组分筛选实验,确定GkOYE蛋白是催化MBH反应的关键。这一发现首次在OYEs中揭示了催化MBH反应的杂泛性,为开发高效催化该反应的酶提供了全新思路。(2)为提高OYEs催化MBH反应的效率,作者分析了OYEs催化还原反应的分子机制,提出阻断H-和H+转移途径以消除还原活性、放大MBH催化功能的策略。通过定点突变切断OYEs与FMN的相互作用,去除FMN辅因子阻断H-转移;突变Y169F阻断H+转移。两种策略结合,获得了还原活性下降98.3%而MBH活性提高141.4%的GkOYE.8突变体。(3)为深入理解GkOYE催化MBH反应的分子机制,该研究通过定点突变、分子对接和动力学模拟等手段,系统阐明了关键催化位点及其作用机制。其中,C26可能作为亲核催化残基参与MBH反应,E59通过水介导的氢键网络去质子化C26巯基,增强其亲核性。这些结果系统阐释了GkOYE催化MBH反应的分子机制,为后续酶改造奠定了基础。(4)随后通过增强底物结合亲和力的策略进行蛋白质工程改造,获得了对映体互补的突变体GkOYE.11和GkOYE.13。其中,GkOYE.11的产率达77.8%,e.r.值为89:11;GkOYE.13的产率为63.1%,e.r.值为23:77。(5)最后,底物适用性实验表明GkOYE.11/13能接受多种芳香醛底物,优先接受对位取代的衍生物。这些结果标志着催化MBH反应的高效OYE变体的成功构建,为手性MBH产物的酶法合成提供了全新工具。
该研究首次在OYE家族中发现了催化MBH反应的,并通过阻断还原反应途径将其转化为主要催化功能,实现了催化选择性的逆转。随后,阐明了GkOYE催化MBH反应的分子机制,并通过定向进化获得的对映体互补的突变体GkOYE.11和GkOYE.13。GkOYE变体能接受多种芳香醛和烯烃作为底物,极大拓展了酶催化MBH反应的适用范围。这些发现为开发基于OYEs催化新反应的生物催化过程提供了新策略,有望加速非天然手性化合物的绿色合成。该成果获国家重点研发计划(2021YFC2100100)和国家自然科学基金(22378165)等项目资助。
文章链接:https://www.nature.com/articles/s41467-024-50141-2
课题组(微生物制造工程研究中心)链接:https://fmme.jiangnan.edu.cn/
图形摘要
